Hidrocarburos
El compuesto más simple es el metano, un átomo de carbono con cuatro de hidrógeno (valencia = 1), pero también puede darse la unión carbono-carbono, formando cadenas de distintos tipos, ya que pueden darse enlaces simples, dobles o triples. Cuando el resto de enlaces de estas cadenas son con hidrógeno, se habla de hidrocarburos, que pueden ser:
- Saturados: con enlaces covalentes simples, alcanos.
- Insaturados, con dobles enlaces covalentes (alquenos) o triples (alquinos).
- Hidrocarburos cíclico: Hidrocarburos saturados con cadena cerrada, como el ciclohexano.
- Aromáticos: estructura cíclica.
[editar]Radicales y ramificaciones de cadena
Los radicales son fragmentos de cadenas de carbonos que cuelgan de la cadena principal. Su nomenclatura se hace con la raíz correspondiente (en el caso de un carbono met-, dos carbonos et-...) y el sufijo -il. Además, se indica con un número, colocado delante, la posición que ocupan. El compuesto más simple que se puede hacer con radicales es el 2-metilpropano. En caso de que haya más de un radical, se nombrarán por orden alfabético de las raíces. Por ejemplo, el 2-etil, 5-metil, 8-butil, 10-docoseno.
[editar]Clasificación según los grupos funcionales
Los compuestos orgánicos también pueden contener otros elementos, también otros grupos de átomos además del carbono e hidrógeno, llamados grupos funcionales. Un ejemplo es el grupo hidroxilo, que forma los alcoholes: un átomo de oxígeno enlazado a uno de hidrógeno (-OH), al que le queda una valencia libre. Asimismo también existen funcionesalqueno (dobles enlaces), éteres, ésteres, aldehidos, cetonas, carboxílicos, carbamoilos, azo, nitro o sulfóxido, entre otros.
[editar]Oxigenados
Son cadenas de carbonos con uno o varios átomos de oxígeno. Pueden ser:
- Alcoholes: Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
- Aldehídos: Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al :
Es decir, el grupo carbonilo H-C=O está unido a un solo radical orgánico.
- Cetonas: Una cetona es un compuesto orgánico caracterizado por poseer un grupo funcional carbonilo unido a dos átomos de carbono, a diferencia de un aldehído, en donde el grupo carbonilo se encuentra unido al menos a un átomo de hidrógeno.1 Cuando el grupo funcional carbonilo es el de mayor relevancia en dicho compuesto orgánico, las cetonas se nombran agregando el sufijo -ona al hidrocarburo del cual provienen (hexano, hexanona; heptano, heptanona; etc). También se puede nombrar posponiendo cetona a los radicales a los cuales está unido (por ejemplo: metilfenil cetona). Cuando el grupo carbonilo no es el grupo prioritario, se utiliza el prefijo oxo- (ejemplo: 2-oxopropanal).
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno. El tener dos átomos de carbono unidos al grupo carbonilo, es lo que lo diferencia de los ácidos carboxílicos, aldehídos, ésteres. El doble enlace con el oxígeno, es lo que lo diferencia de los alcoholes y éteres. Las cetonas suelen ser menos reactivas que los aldehídos dado que los grupos alquílicos actúan como dadores de electrones por efecto inductivo.
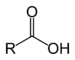
- Ácidos carboxílicos: Los ácidos carboxílicos constituyen un grupo de compuestos que se caracterizan porque poseen un grupo funcional llamado grupo carboxilo o grupo carboxi (–COOH); se produce cuando coinciden sobre el mismo carbono un grupo hidroxilo (-OH) y carbonilo (C=O). Se puede representar como COOH ó CO2H...
- Ésteres: Los ésteres presentan el grupo éster (-O-CO-) en su estructura. Algunos ejemplos de sustancias con este grupo incluyen el ácido acetil salicílico, componente de la aspirina, o algunos compuestos aromáticos como el acetato de isoamilo, con característico olor a plátano. Los aceites también son ésteres de ácidos grasos con glicerol.
- Éteres: Los éteres presentan el grupo éter(-O-) en su estructura. Suelen tener bajo punto de ebullición y son fácilmente descomponibles. Por ambos motivos, los éteres de baja masa molecular suelen ser peligrosos ya que sus vapores pueden ser explosivos.
[editar]Nitrogenados
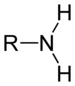
- Aminas: Las aminas son compuestos orgánicos caracterizados por la presencia del grupo amina (-N<). Las aminas pueden ser primarias (R-NH2), secundarias (R-NH-R") o terciarias (R-NR´-R"). Las aminas suelen dar compuestos ligeramente amarillentos y con olores que recuerdan a pescado u orina.
- Amidas: Las amidas son compuestos orgánicos caracterizados por la presencia del grupo amida (-NH-CO-) en su estructura. Las proteínas o polipéptidos son poliamidasnaturales formadas por enlaces peptídicos entre distintos aminoácidos.
- Isocianatos: Los isocianatos tienen el grupo isocianato (-N=C=O). Este grupo es muy electrófilo, reaccionando facilmente con el agua para descomponerse mediante latransposición de Hofmann dar una amina y anhídrico carbónico, con los hidroxilos para dar uretanos, y con las aminas primarias o secundarias para dar ureas.
[editar]Cíclicos
Son compuestos que contienen un ciclo saturado. Un ejemplo de estos son los norbornanos, que en realidad son compuestos bicíclicos, los terpenos, u hormonas como elestrógeno, progesterona, testosterona u otras biomoléculas como el colesterol.
[editar]Aromáticos
Los compuestos aromáticos tienen estructuras cíclicas insaturadas. El benceno es el claro ejemplo de un compuesto aromático, entre cuyos derivados están el tolueno, el fenol o el ácido benzoico. En general se define un compuesto aromático aquel que tiene anillos que cumplen la regla de Hückel, es decir que tienen 4n+2 electrones en orbitales π (n=0,1,2,...). A los compuestos orgánicos que tienen otro grupo distinto al carbono en sus cilos (normalmente N, O u S) se denominan compuestos aromáticos heterocíclicos. Así los compuestos aromáticos se suelen dividir en:
- Derivados del benceno: Policíclicos (antraceno, naftaleno, fenantreno, etc), fenoles, aminas aromáticas, fulerenos, etc
- Compuestos heterocíclicos: Piridina, furano, tiofeno, pirrol, porfirina, etc
[editar]Isómeros
Ya que el carbono puede enlazarse de diferentes maneras, una cadena puede tener diferentes configuraciones de enlace dando lugar a los llamados isómeros, moléculas tienen la misma fórmula química pero distintas estructuras y propiedades.
Existen distintos tipos de isomería: isomería de cadena, isomería de función, tautomería, estereoisomería, y estereoisomería configuracional.
El ejemplo mostrado a la izquierda es un caso de isometría de cadena en la que el compuesto con fórmula C6H12 puede ser un ciclo (ciclohexano) o un alqueno lineal, el 1-hexeno. Un ejemplo de isomería de función sería el caso delpropanal y la acetona, ambos con fórmula C3H6O.
Existen distintos tipos de isomería: isomería de cadena, isomería de función, tautomería, estereoisomería, y estereoisomería configuracional.
El ejemplo mostrado a la izquierda es un caso de isometría de cadena en la que el compuesto con fórmula C6H12 puede ser un ciclo (ciclohexano) o un alqueno lineal, el 1-hexeno. Un ejemplo de isomería de función sería el caso delpropanal y la acetona, ambos con fórmula C3H6O.